А.Я. Яшин, Н.И. Черноусова
НПО «Химавтоматика»
Основная причина патологических процессов в человеческом организме, вызывающих преждевременное старение и развитие многих болезней — избыточное накопление в организме кислородных свободных радикалов. За счет вредного воздействия свободных радикалов повреждаются стенки сосудов, мембраны, окисляются липиды. Это состояние называют оксидантным стрессом [1, 2].
Концентрация свободных радикалов возрастает за счет снижения естественной антиоксидантной системы человека, вызванной воздействием радиации, УФ-облучения, курения, алкоголизма, некоторых лекарств, постоянных стрессов, некачественной загрязненной пищи.
Вредное воздействие свободных радикалов можно уменьшить систематическим употреблением пищевых продуктов и напитков, лекарственных растительных препаратов, биологически активных добавок, обладающих высокой антиоксидантной активностью. Ранее наиболее известными природными антиоксидантами считали витамины Е, С и каротиноиды. Однако эти антиоксиданты не обладают достаточной активностью для эффективного применения с целью коррекции антиоксидантного статуса человека [3 –9].
Особую ценность представляют биофлавоноиды, обладающие антиканцерогенными, антисклеротическими, противовоспалительными и антиаллергическими свойствами. По антиоксидантной активности они в десятки раз превосходят витамины С, Е и каротиноиды. Особенно активно природное сочетание биофлавоноидов [10–12]. Основные источники этих антиоксидантов — фрукты, овощи, ягоды, мед, чай, красное вино, растительные масла.
Большинство природных антиоксидантов поступает в организм человека с этими продуктами. При систематическом употреблении пищевых продуктов и напитков, содержащих природные антиоксиданты, заболеваемость населения опасными социально значимыми заболеваниями значительно ниже. В странах Средиземноморского региона заболеваемость сердечно-сосудистыми и онкологическими заболеваниями значительно ниже, чем в северных европейских странах, что связывают с особенностью диеты в этих странах – повышенным потреблением фруктов, овощей, оливкового масла, рыбы, вина [13].
Общеизвестен так называемый «французский парадокс» [14]. В США более 30 лет назад ежегодно от сердечно-сосудистых заболеваний умирало более 800 тыс. мужчин в возрасте 40-65 лет. Для сокращения смертности была создана специальная программа оздоровления, включающая постоянную физическую нагрузку, употребление нежирной пищи, исключение курения. Через 20-25 лет смертность от инфаркта в США сократилась в 2 раза; но далее не уменьшалась. Во Франции мужчины умирают от инфаркта в 2 раза реже, чем в США. хотя никаких специальных программ оздоровления не было. Это связывают со значительным употреблением французами красного вина, в котором очень много антиоксидантов.
Регулярное потребление фруктов, овощей, оливкового масла, красного вина, чая значительно снижает риск сердечно-сосудистых и онкологических заболеваний [15–19].
Растительные пищевые продукты содержат сотни разных антиоксидантов. Необходимо знание их общей антиоксидантной способности, так как поглощение свободных радикалов связано с их кумулятивным действием. Определено общее содержание антиоксидантов в растительных пищевых продуктах (фрукты, ягоды, овощи, злаки, орехи и корнеплоды) [20]. Были проанализированы три или более проб из трех разных регионов мира.
Общее содержание антиоксидантов определяли методом FRAP (восстановление Fe3+ до Fe2+). Содержание антиоксидантов в разных пищевых растениях различалось более чем в 1000 раз. Наибольшее количество оксидантов в шиповнике, черной смородине, клубнике, малине, чернике, клюкве. В Норвегии с фруктами, ягодами, зерновыми в рацион питания поступает 43.6; 27.1 и 11.7 % растительных оксидантов, соответственно, с овощами — только 8.9 %.
Также установлена антиоксидантная способность (АС) пищевых продуктов, наиболее часто употребляемых в Италии: 34 овощей, 30 фруктов, 34 напитков и шести растительных масел [27].
Для измерения использовали три разных метода: ТЕАС, TRAP, FRAP. Среди овощей наибольшую антиоксидантную способность показывал шпинат в методах ТЕАС, FRAP и спаржа — в методе TRAP. Среди ягод наибольшей АС обладают черная и красная смородина, малина, среди напитков ~ кофе, затем цитрусовые соки, среди масел — соевое.
Установлена общая АС пищевых продуктов как сумма липофильных и гидрофильных антиоксидантных величин, измеренных модифицированным методом поглощения кислорода (ORАС) [20]. Гидрофильную экстракцию проводили смесью растворителей (ацетон, вода, уксусная кислота), а гидрофобную — смесью гексана и дихлорметана (1:1). Была определена общая AC 28 пищевых продуктов из четырех регионов США, включающих фрукты, овощи, орехи, сухие фрукты и зерна риса.
Доля гидрофильной АС в 5–50 раз больше. При тепловой обработке овощей АС обычно уменьшалась, за исключением помидор и картофеля, у которых она возрастала. Исследована АС 14 типов соков, употребляемых в европейских странах (яблочный, свекольный, черничный, морковный, лимонный, мультивитаминный, апельсиновый, розовый грейпфрутовый, томатный и др.) [28]. Соки изучали по их способности улавливать три типа кислородных смесей (пероксид радикал, гидроксил радикал и пероксинитрит). Наибольшая АС отмечена у соков, содержащих антоцианины (черничный, вишневый и др.).
Нами были изучены природные антиоксиданты в основных ежедневно употребляемых пищевых продуктах и напитках в нашей стране.
Измерения проводили на приборе «ЦветЯуза-01-АА». Амперометрический детектор в приборе работал в окислительном режиме. В ячейке детектора на поверхности рабочего электрода происходит окисление молекул исследуемого вещества, при этом возрастает электрический ток между двумя электродами. Величина электрического тока зависит от природы анализируемого вещества, природы рабочего электрода и потенциала, приложенного к электроду.
Возникающие электрические токи очень малы и находятся в пределах 10-6 – 10-10 А. Эти аналоговые сигналы усиливаются, а затем с помощью аналогово-цифрового преобразователя (АЦП) преобразуются в цифровой сигнал, который регистрируется на дисплее компьютера, в случае необходимости выходные результаты можно распечатать на принтере.
Рабочий электрод выполнен из стеклоуглерода, который наиболее универсален при определении полифенольных соединений. Потенциал может изменяться от 0 до +2 В. потенциалы ионизации фенольных соединений — в пределах 100–1200 мВ
Электрохимическое окисление может быть использовано как модельное при измерении активности поглощения свободных радикалов в соответствии со следующими уравнениями:
флавоноид-О-Н флавоноид-О’ + ? + Н+ (окисление при максимальном потенциале),
флавоноид-О-Н флавоноид-О’ + Н” (улавливание свободного радикала).
Обе реакции включают разрыв одной и той же связи О-Н, Н” состоит из ? + Н+. Таким образом, способность к захвату свободных радикалов флавоноидами или другими полифенолами (т. е. их антиоксидантная активность) [20] может измеряться величиной окисляемости этих соединений на рабочем электроде амперометрического детектора. Сигнал регистрируется в виде дифференциальных выходных кривых. С помощью специального программного обеспечения производится расчет площадей или высот пиков (дифференциальных кривых) анализируемого и стандартного веществ. Для анализа используется среднее значение из трех-пяти последовательных измерений. В качестве стандартных веществ можно применять общеизвестные антиоксиданты: рутин, кверцетин, дигидрокверцетин, мексидол, тролокс, аскорбиновую кислоту, галловую кислоту и др. Амперометрический прибор имеет ряд преимуществ при определении антиоксидантной активности. Без учета пробоподготовки время отдельного определения занимает несколько минут. Анализ (регистрация и обработка результатов) проводится в реальном времени; правильность и воспроизводимость анализа обеспечивается за счет точного дозирования шестиходовым краном; объем дозируемой петли может меняться от 20 до 500 мкл; среднеквадратическое отклонение (СКО) дозирования краном менее 0,5 %; СКО последовательных измерений анализируемых проб < 3 %. Предел обнаружения амперометрического детектора полифенолов, флавоноидов на уровне нано-пикограммов (10-9 – 10-12 г). Метод обладает высокой селективностью определения только антиоксидантов, т. е. соединений, способных к окислению, другие соединения, присутствующие в сложных смесях, не мешают их определению. Для анализа не требуется никаких химических реактивов (кроме стандартов), поэтому стоимость измерений очень низкая. Меняя величину приложенного потенциала, можно дифференцировать антиоксиданты по классам. Дифференциация возрастает при применении имеющегося в приборе импульсного режима работы амперометрического детектора, кроме того, можно определять в автоматическом режиме вольтамперограммы для идентификации антиоксидантов.
Амперометрический метод — единственный непосредственно измеряющий содержание всех антиоксидантов в пробе. Другие методы — непрямые, в них измеряется ингибирование реакционных смесей (в частности, свободных радикалов), генерированных определенными реакциями. Методом восстановления Fe3+ до Fe2+ (метод FRAP) также можно суммарно определять антиоксиданты, однако не все, в частности тиолы, так как их восстановительный потенциал значительно ниже потенциала превращения Fe3+ в Fe2+ [20]. Амперометрический метод успешно был применен для определения антиоксидантной способности разных вин [21]. Это прямой, точный, объективный и быстрый метод. Он был применен для определения антиоксидантной способности оливковых масел из разных стран [22]. Метод позволяет оценить качество, подлинность оливкового масла. Амперометрический (электрохимический) метод применяется также для определения антиоксидантного статуса человека [23]. Общие принципы электрохимического определения рассмотрены в обзоре (24). Амперометрический детектор в комбинации с высокоэффективной жидкостной хроматографией широко используется для определения полифенолов в пищевых продуктах и напитках (25) и кверцетина после употребления зеленого чая, аскорбиновой и дигидроаскорбиновой кислот в плазме и спинно-мозговой жидкости [26].
В НТЦ «Хроматография» НПО «Химавтоматика» выполнен большой объем измерений антиоксидантной активности (АОА) разных пищевых продуктов и напитков [29–31]. В табл. 1, 2, 3 приведена относительная АОА свежевыжатых соков фруктов и овощей урожая 2005 г., которая зависит от их сорта, места произрастания и времени хранения. АОА пчелиного меда разных сортов находится в пределах 0,05’ 0,45 мг/г (образцы меда были получены на ярмарках меда в Коломенском и в Манеже в 2003-2007 гг.). В табл. 4 приведена АОА основных напитков, в табл. 5 — некоторых БАДов.
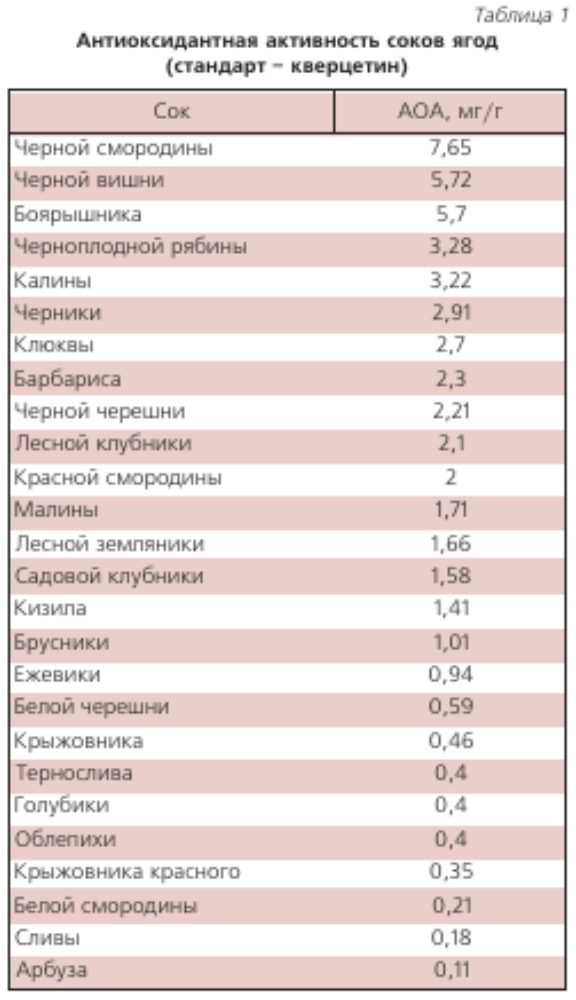
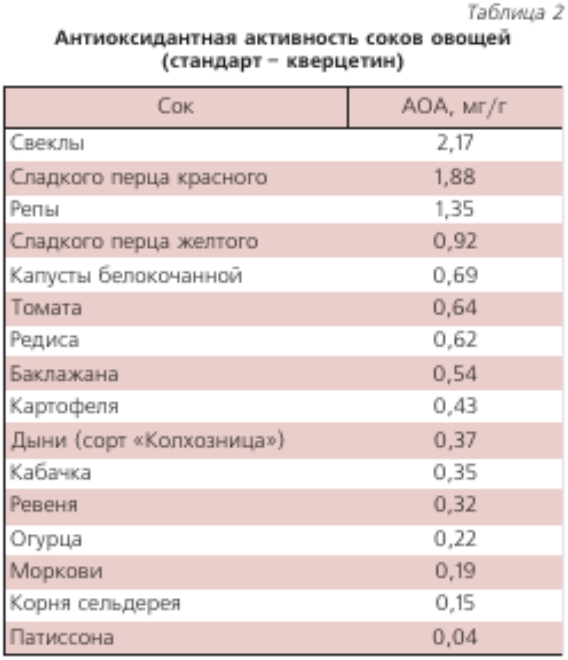

Для водорастворимых проб в качестве стандарта использовали кверцетин (фирмы «Флука»). Перед измерениями строили градуировочный график зависимости сигналов кверцетина (площади пиков) от концентрации кверцетина. Значение суммарного содержания антиоксидантов в соках, в частности, в черной смородине 9.7 мг/мл, означает, что АОА 1 мл сока черной смородины равна 9,7 мг кверцетина.
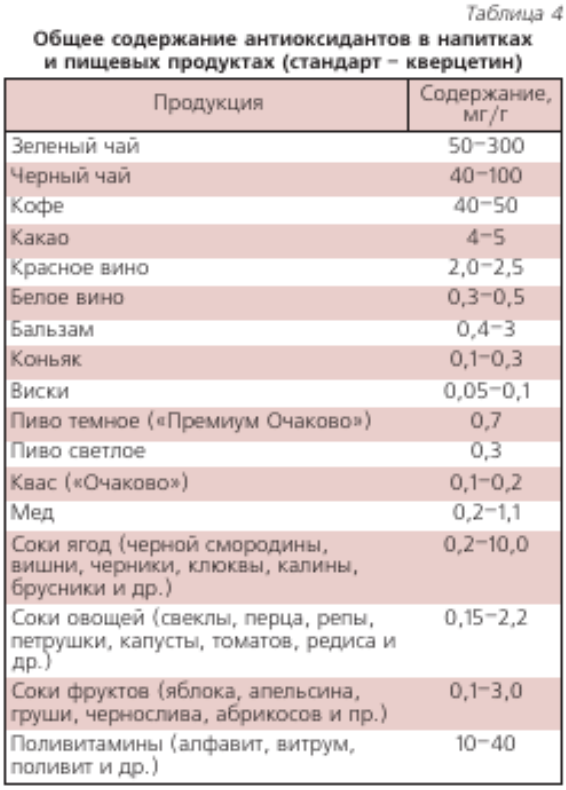
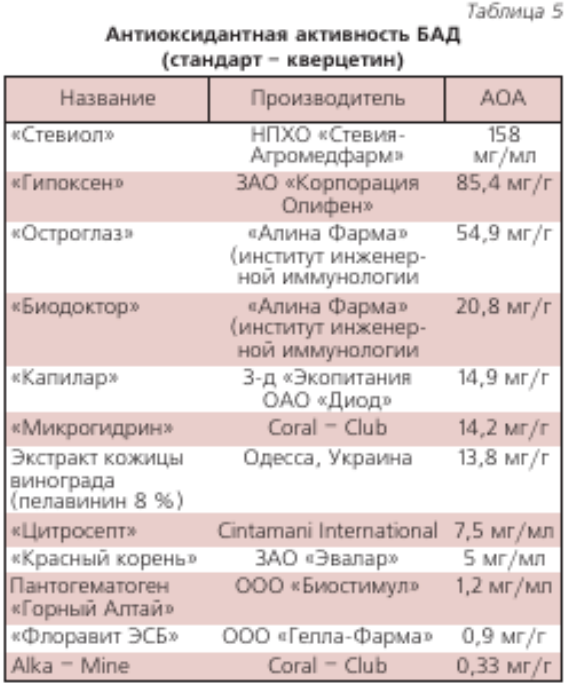
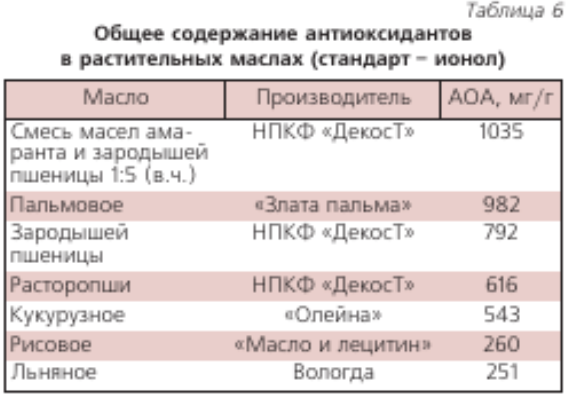
Для определения содержания антиоксидантов в жирорастворимых пробах, в частности, в растительных маслах в качестве стандарта применяли ионол (табл. 6). Очень высокое антиоксидантов содержание в масле амаранта и зародышей пшеницы, а также пальмовом масле. В последнем обнаружено много изомера витамина Е–Y-токотриенола, обладающего значительно большей АОА, чем наиболее распространенный изомер витамина Е–?-токоферол.
Знания суммарного содержания природных антиоксидантов в основных пищевых продуктах и напитках позволяют использовать их для антиоксидантной терапии, а также для создания напитков и пищевых продуктов с повышенной АОА.
ЛИТЕРАТУРА
- Болдырев А.А.//Соросовский образовательный журнал. 2001. Т. 7. № 4. С. 21-28
- Владимиров Ю.А.//Вестник РАМН. 1998. Т. 7. С. 43~56.
- Gutte ridge J.M., Halliwell В.//Ann. N.Y. Acad. Sa. 2000. V. 899. P. 136-147.
- Halliwell B.//free Radical. Res. 1999. V. 31. P. 261-272.
- Carr A.. Frei B.//Faseb. J. 1999. V. 13. P.1007-1024.
- Sies H., Stahe H?//Am. J. Gin. Nutr. 1995. V. 62. P. 1315-1321.
- Pocker L, Weber S. U.f Rimbach G. Z//Nutr. 2001. V. 131. P. 369-373.
- Halliwell B.//Lancet. 2000. V. 355. P. 1179-1180.
- McCall M.R., Frei B. Free Radical.// Biol. Med 1999. V. 26. P. 1034-1053.
- Гудковский В.А. Пути повышения устойчивости садоводства. ~ Мичуринск, 1998, с. 30-35.
- Kalt N.. Kushad M.M.//Hort Science. 2000. V. 35. Р. 572.
- Kaur С. Kapoor Н.С.//Intern. Journal, of Food Sci.and Techn. 2001. V. 36. № 7. P.703.
- Simopoulos А.Р.//J. Nutr. 2001. V. 131. P. 3065-73.
- Renaud S., De Lorgeril M.//Lancet. 1992. V. 339. P 1523-1526.
- Lampe J. W.//American Journal of Clinical Nutrition. 1999. V. 70. P. 4755” 4905.
- Prior R.I., Cao 6.//Hort. Sa. 2000. P. 588-592.
- La Vecchia C.. Altieri A.., Tovani A./ /Eur. J. Nutr. 2001. V. 40. P. 261-267.
- Terry P., Terry J.B., Wolk А.//I. Intern. Med. 2001. V. 250’290. P. 280” 290.
- Sera f ini M., Bellocco R., Wolk A. J./ /Gastroenterology. 2002. V. 123, P. 985999.
- Halvorsen B.L., Holte K., Myhrstad M.C.W. et al.//). Nutr. 2002. V. 132. P. 461-471.
- Mannino S., Brenna O.. Buratti S., Cosio A4.S.//Electroanafysis. 1998. V. 10. P. 908-912.
- Mannino S.. Buratti S., Cosio M.S., Pellegrini N.//Analyst. 1999. V. 124. P. 1115-1118.
- Hensley K.//). High Resolut. Chromat. 1999. V. 22. P. 429-437.
- Kilmartm P.A.//Antioxidants and Redox Signaling. 2001. V. 3. N* 6. P. 941955.
- Buratti S., Pellegrini N.. Brenna O.V., Mannino S.//). Agric Food Chem. 2001. V. 49. № 11. P. 5136-5141.
- Kusu F., Jin D.//Biomed Chromatog. 2004. V. 18. P. 25.
- Pellegrini N.. Sera fini M., Colombi B et al.//J. Nutr. 2003. V. 133. P. 2812’ 2819.
- Reyrat-Maillard M.N., Bonnely S., Berset C.//Taianta. 2000. V. 51. P. 709″ 716.
- Пахомов В.П., Яшин Я.И.//Перспективы традиционной медицины 2003. № 3. С. 14-18.
- Яшин А.Я., Яшин Я.И.//Приборы и автоматизация. 2004. №11. С. 45-48.
- Яшин А Я., Яшин Я.И., Черноусова Н.И., Пахомов В.П.//Пиво и напитки. 2004. N! 6. С. 44-46.
