Запрос коммерческих предложений на выполнение ремонтных работ в столовой по адресу:
129226, г. Москва, ул. Сельскохозяйственная 12А., стр. 7
(закупка завершена)
Запрос коммерческих предложений на выполнение ремонтных работ в столовой по адресу:
129226, г. Москва, ул. Сельскохозяйственная 12А., стр. 7
(закупка завершена)
(закупка завершена)
(закупка завершена)
(закупка завершена)
(закупка завершена)
(закупка завершена)
(закупка завершена)
Научно-производственное объединение «Химавтоматика» имеет более чем полувековой опыт конструкторских и научно-исследовательских работ в сферах создания средств автоматизации и химико-аналитического приборостроения для использования в химической, нефтехимической, газоперерабатывающей, биологической и других отраслях промышленности. Продукция предприятия широко применяется в различных отраслях промышленности, в заказах Минобороны РФ на стартовых комплексах космодромов и в системах жизнеобеспечения в замкнутых автономных пространствах, в химико-аналитических лабораториях различных ведомств, НИИ, высших учебных заведениях, в медицинских учреждениях.
О том, чем живет компания сегодня, рассказывает заместитель генерального директора по общим вопросам Александра Сулимина.
– Как развивалась компания «Химавтоматика» и что она представляет из себя сегодня?
– У компании давняя история. Еще в 1949-ом году Министерство химической промышленности СССР организовало Опытно-Конструкторское Бюро Автоматики (ОКБА), которое в 1979-ом году было переименовано в НПО «Химавтоматика». После распада СССР в результате приватизации, государственное предприятие» было преобразовано в ОАО НПО «Химавтоматика». Сегодня компания разрабатывает и изготавливает аналитические приборы и системы различного назначения: от простейших одноразовых индикаторов воздуха и газоанализаторов до хроматографов широко профиля, автоматизированных систем контроля химической обстановки на различных объектах, уникальных автоматизированных комплексов медицинского назначения. В данный момент компания сфокусирована на восстановлении производства медицинской техники. Инфраструктура позволяет провести весь цикл разработки аналитического прибора (системы), начиная со стадии его эскизного проектирования до изготовления и испытаний опытного образца и постановки изделия на серийное производство в достаточно короткие сроки.
– В чем особенность и уникальность именно Вашей продукции? Расскажите чуть подробнее, пожалуйста.
– Уникальность наших приборов в их простоте, стоимости расходных материалов и надежности. Сегодня разработки компании помогают российским лечебным учреждениям существенно экономить средства. Например, автоматизированный комплекс КАДС-80-01 «Эндостерил» – оригинальная разработка предприятия, он предназначен для дезинфекции, предстерилизационной очистки и стерилизации гибких эндоскопов. Это единственный комплекс, использующий анолит АНК для мойки эндоскопов. А анолит – это раствор, получаемый в самом комплексе непосредственно в процессе обработки эндоскопов. Все, что нужно для производства раствора – это водопроводная вода, электроэнергия и небольшое количество соли, поэтому он в несколько раз дешевле всех известных дезинфицирующих средств. И применение «Эндостерила» позволяет лечебно-профилактическим учреждениям не только экономить значительные средства, так как нет необходимости приобретать дорогостоящие дезинфицирующие вещества, но и избежать неудобств в связи с их хранением. Он способен полностью заменить на российском рынке импортные моющие машины, так как может работать и на анолите, и на любом штатном дезинфицирующем средстве. Для этого можно использовать режим «автономный контур», в котором, кроме того предусмотрен процесс ополаскивания обеззараженной водой, получаемой в Комплексе «Эндостерил».
Среди других интересных разработок – жидкостный хроматограф «ЦВЕТЯУЗА». В медицине он может применяться для целого ряда манипуляций: оценки прединфарктного состояния по анализу гомоцистеина в плазме, получения аналитической информации для диагностики заболеваний (феохромацитома, нейробластома, гипертония, болезнь Паркинсона, шизофрения, эпилепсия и др.); для анализа некоторых стероидов, гормонов аминокислот, нуклеозидов, пептидов, фрагментов ДНК и многих других биологически активных соединений, а также для других случаев. У прибора много достоинств: высокая чувствительность с низким пределом обнаружения, позволяющая определять многие соединения без концентрирования, избирательность ко многим классам соединений; высокая надёжность, лёгкость обслуживания, компьютерный комплекс сбора, обработки и хранения хроматографических данных, выдача объективных результатов анализа в виде полного протокола, и, наконец, его стоимость в 3-5 раз дешевле импортных аналогов.
Еще одна разработка компании – прибор для определения антиоксидантной активности “ЦВЕТЯУЗА-01-АА”. Он служит для суммарного определения антиоксидантов (антиоксидантной активности) в пищевых продуктах, напитках, биологически активных добавках (БАД) и в лекарственных препаратах. Анализ антиоксидантов позволяет определить биологическую ценность пищевых продуктов и напитков; оценить сроки их хранения; создавать новые пищевые продукты и напитки с повышенным содержанием природных антиоксидантов; быстро оценить состояние здоровья человека по определению антиоксидантного статуса, назначить правильное лечение и контролировать ход антиоксидантной терапии и др. Предел обнаружения антиоксидантов – это нано и пикограммы, которые в мельчайших долях измеряемых величин позволяют качественно оценивать состав продуктов и материалов. Это очень важный инструмент, помощь в определении ценности конкретных продуктов, биологически активных добавок, экстрактов лекарственных растений, которые мы покупаем в пузырьках. Это единственный прибор такого типа, включенный в Госреестр и с аттестованной методикой (Методика выполнения измерений содержания антиоксидантов в напитках и пищевых продуктах, биологически активных добавках, экстрактах лекарственных растений амперометрическим методом).
– Можно ли назвать бизнес «Химавтоматики» инновационным?
– Нет, сегодня наш бизнес не инновационный, но дело в том, что разработки прошлых лет, сделанные специалистами «Химавтоматики», востребованы на рынке и являются конкурентоспособными. Как сказано ранее, мы восстанавливаем производство и планируем его модернизацию и развитие. В этих планах, безусловно, будет присутствовать и инновационный подход.
– А на какие рынки Вы ориентируетесь прежде всего – российские или международные?
– Мы ориентируемся на российский рынок по двум причинам: во-первых, отечественный рынок не наполнен изделиями российского производителя, во-вторых, «Химавтоматика» хорошо знает особенности российского потребителя медицинской техники. Страны ближнего зарубежья являются следующим направлением, на которое мы ориентируем свою продукцию. Ближнее зарубежье имеет рынок во многом схожий с российским по структуре спроса, платежеспособности. Именно поэтому, мы рассматриваем страны бывшего СССР, а также Индию, страны Латинской Америки и Африки как перспективное направление для нас. В настоящее время у нас нет международных сертификатов на нашу продукцию, но мы планируем подавать заявки на их получение по мере конкретизации своих планов по ее продвижению.
– Как бы вы могли оценить инновационный потенциал российских предприятий в целом и в Зеленограде в частности? Мешает нам что-то в полной мере его реализовать?
– Инновационный потенциал российских предприятий и предприятий Зеленограда достаточно высок, но для того, чтобы проекты реализовывались, нужны доступные государственные программы по льготному налогообложению и кредитованию предприятий малого и среднего бизнеса, рассчитанные на длительные сроки. Необходимы также образовательные программы, которые позволили бы инженерным центрам и малым предприятиям выйти на новый технологический уровень.
– Какие Вы видите перспективы для развития компании?
– Наши перспективы будут зависеть от состояния российской экономики в целом. В ближайший год мы планируем увеличить выпуск медицинских приборов. Следующим шагом будет обновление и модернизация продукции, а затем – разработка принципиально новых изделий медицинской техники для российского рынка. В компании трудятся очень грамотные специалисты.
– Что вы хотите улучшить? В технологиях, в маркетинге, в сбыте, в партнерской сети, в работе персонала?
– Честно говоря, предприятию есть над чем работать во всех перечисленных областях. Особенно остро стоит вопрос кадров и финансирования разработок новых изделий. Сейчас очень сложно найти квалифицированных специалистов с опытом практической работы в производственных и конструкторских подразделениях.
– Какой совет Вы могли бы дать молодым разработчикам? В том числе и компаниям Зеленограда?
– Учиться, совершенствоваться, приобретать опыт.
– Активно ли вы взаимодействуете с КП «Корпорация развития Зеленограда»? И какой характер носит взаимодействие?
– Да, мы активно работаем с КП КРЗ. Особенно мы благодарны за организационную работу по подготовке к выставке «Здравоохранение–2016», в результате которой наше предприятие получило возможность представить свою продукцию потребителю. Профессионализм сотрудников КП «Корпорация развития Зеленограда и внимание, которое руководство уделяет поддержке производственных предприятий, дает нам надежду, что это сотрудничество будет долгосрочным и плодотворным.
А.Я. Яшин, Н.И. Черноусова
НПО «Химавтоматика»
Основная причина патологических процессов в человеческом организме, вызывающих преждевременное старение и развитие многих болезней — избыточное накопление в организме кислородных свободных радикалов. За счет вредного воздействия свободных радикалов повреждаются стенки сосудов, мембраны, окисляются липиды. Это состояние называют оксидантным стрессом [1, 2].
Концентрация свободных радикалов возрастает за счет снижения естественной антиоксидантной системы человека, вызванной воздействием радиации, УФ-облучения, курения, алкоголизма, некоторых лекарств, постоянных стрессов, некачественной загрязненной пищи.
Вредное воздействие свободных радикалов можно уменьшить систематическим употреблением пищевых продуктов и напитков, лекарственных растительных препаратов, биологически активных добавок, обладающих высокой антиоксидантной активностью. Ранее наиболее известными природными антиоксидантами считали витамины Е, С и каротиноиды. Однако эти антиоксиданты не обладают достаточной активностью для эффективного применения с целью коррекции антиоксидантного статуса человека [3 –9].
Особую ценность представляют биофлавоноиды, обладающие антиканцерогенными, антисклеротическими, противовоспалительными и антиаллергическими свойствами. По антиоксидантной активности они в десятки раз превосходят витамины С, Е и каротиноиды. Особенно активно природное сочетание биофлавоноидов [10–12]. Основные источники этих антиоксидантов — фрукты, овощи, ягоды, мед, чай, красное вино, растительные масла.
Большинство природных антиоксидантов поступает в организм человека с этими продуктами. При систематическом употреблении пищевых продуктов и напитков, содержащих природные антиоксиданты, заболеваемость населения опасными социально значимыми заболеваниями значительно ниже. В странах Средиземноморского региона заболеваемость сердечно-сосудистыми и онкологическими заболеваниями значительно ниже, чем в северных европейских странах, что связывают с особенностью диеты в этих странах – повышенным потреблением фруктов, овощей, оливкового масла, рыбы, вина [13].
Общеизвестен так называемый «французский парадокс» [14]. В США более 30 лет назад ежегодно от сердечно-сосудистых заболеваний умирало более 800 тыс. мужчин в возрасте 40-65 лет. Для сокращения смертности была создана специальная программа оздоровления, включающая постоянную физическую нагрузку, употребление нежирной пищи, исключение курения. Через 20-25 лет смертность от инфаркта в США сократилась в 2 раза; но далее не уменьшалась. Во Франции мужчины умирают от инфаркта в 2 раза реже, чем в США. хотя никаких специальных программ оздоровления не было. Это связывают со значительным употреблением французами красного вина, в котором очень много антиоксидантов.
Регулярное потребление фруктов, овощей, оливкового масла, красного вина, чая значительно снижает риск сердечно-сосудистых и онкологических заболеваний [15–19].
Растительные пищевые продукты содержат сотни разных антиоксидантов. Необходимо знание их общей антиоксидантной способности, так как поглощение свободных радикалов связано с их кумулятивным действием. Определено общее содержание антиоксидантов в растительных пищевых продуктах (фрукты, ягоды, овощи, злаки, орехи и корнеплоды) [20]. Были проанализированы три или более проб из трех разных регионов мира.
Общее содержание антиоксидантов определяли методом FRAP (восстановление Fe3+ до Fe2+). Содержание антиоксидантов в разных пищевых растениях различалось более чем в 1000 раз. Наибольшее количество оксидантов в шиповнике, черной смородине, клубнике, малине, чернике, клюкве. В Норвегии с фруктами, ягодами, зерновыми в рацион питания поступает 43.6; 27.1 и 11.7 % растительных оксидантов, соответственно, с овощами — только 8.9 %.
Также установлена антиоксидантная способность (АС) пищевых продуктов, наиболее часто употребляемых в Италии: 34 овощей, 30 фруктов, 34 напитков и шести растительных масел [27].
Для измерения использовали три разных метода: ТЕАС, TRAP, FRAP. Среди овощей наибольшую антиоксидантную способность показывал шпинат в методах ТЕАС, FRAP и спаржа — в методе TRAP. Среди ягод наибольшей АС обладают черная и красная смородина, малина, среди напитков ~ кофе, затем цитрусовые соки, среди масел — соевое.
Установлена общая АС пищевых продуктов как сумма липофильных и гидрофильных антиоксидантных величин, измеренных модифицированным методом поглощения кислорода (ORАС) [20]. Гидрофильную экстракцию проводили смесью растворителей (ацетон, вода, уксусная кислота), а гидрофобную — смесью гексана и дихлорметана (1:1). Была определена общая AC 28 пищевых продуктов из четырех регионов США, включающих фрукты, овощи, орехи, сухие фрукты и зерна риса.
Доля гидрофильной АС в 5–50 раз больше. При тепловой обработке овощей АС обычно уменьшалась, за исключением помидор и картофеля, у которых она возрастала. Исследована АС 14 типов соков, употребляемых в европейских странах (яблочный, свекольный, черничный, морковный, лимонный, мультивитаминный, апельсиновый, розовый грейпфрутовый, томатный и др.) [28]. Соки изучали по их способности улавливать три типа кислородных смесей (пероксид радикал, гидроксил радикал и пероксинитрит). Наибольшая АС отмечена у соков, содержащих антоцианины (черничный, вишневый и др.).
Нами были изучены природные антиоксиданты в основных ежедневно употребляемых пищевых продуктах и напитках в нашей стране.
Измерения проводили на приборе «ЦветЯуза-01-АА». Амперометрический детектор в приборе работал в окислительном режиме. В ячейке детектора на поверхности рабочего электрода происходит окисление молекул исследуемого вещества, при этом возрастает электрический ток между двумя электродами. Величина электрического тока зависит от природы анализируемого вещества, природы рабочего электрода и потенциала, приложенного к электроду.
Возникающие электрические токи очень малы и находятся в пределах 10-6 – 10-10 А. Эти аналоговые сигналы усиливаются, а затем с помощью аналогово-цифрового преобразователя (АЦП) преобразуются в цифровой сигнал, который регистрируется на дисплее компьютера, в случае необходимости выходные результаты можно распечатать на принтере.
Рабочий электрод выполнен из стеклоуглерода, который наиболее универсален при определении полифенольных соединений. Потенциал может изменяться от 0 до +2 В. потенциалы ионизации фенольных соединений — в пределах 100–1200 мВ
Электрохимическое окисление может быть использовано как модельное при измерении активности поглощения свободных радикалов в соответствии со следующими уравнениями:
флавоноид-О-Н флавоноид-О’ + ? + Н+ (окисление при максимальном потенциале),
флавоноид-О-Н флавоноид-О’ + Н” (улавливание свободного радикала).
Обе реакции включают разрыв одной и той же связи О-Н, Н” состоит из ? + Н+. Таким образом, способность к захвату свободных радикалов флавоноидами или другими полифенолами (т. е. их антиоксидантная активность) [20] может измеряться величиной окисляемости этих соединений на рабочем электроде амперометрического детектора. Сигнал регистрируется в виде дифференциальных выходных кривых. С помощью специального программного обеспечения производится расчет площадей или высот пиков (дифференциальных кривых) анализируемого и стандартного веществ. Для анализа используется среднее значение из трех-пяти последовательных измерений. В качестве стандартных веществ можно применять общеизвестные антиоксиданты: рутин, кверцетин, дигидрокверцетин, мексидол, тролокс, аскорбиновую кислоту, галловую кислоту и др. Амперометрический прибор имеет ряд преимуществ при определении антиоксидантной активности. Без учета пробоподготовки время отдельного определения занимает несколько минут. Анализ (регистрация и обработка результатов) проводится в реальном времени; правильность и воспроизводимость анализа обеспечивается за счет точного дозирования шестиходовым краном; объем дозируемой петли может меняться от 20 до 500 мкл; среднеквадратическое отклонение (СКО) дозирования краном менее 0,5 %; СКО последовательных измерений анализируемых проб < 3 %. Предел обнаружения амперометрического детектора полифенолов, флавоноидов на уровне нано-пикограммов (10-9 – 10-12 г). Метод обладает высокой селективностью определения только антиоксидантов, т. е. соединений, способных к окислению, другие соединения, присутствующие в сложных смесях, не мешают их определению. Для анализа не требуется никаких химических реактивов (кроме стандартов), поэтому стоимость измерений очень низкая. Меняя величину приложенного потенциала, можно дифференцировать антиоксиданты по классам. Дифференциация возрастает при применении имеющегося в приборе импульсного режима работы амперометрического детектора, кроме того, можно определять в автоматическом режиме вольтамперограммы для идентификации антиоксидантов.
Амперометрический метод — единственный непосредственно измеряющий содержание всех антиоксидантов в пробе. Другие методы — непрямые, в них измеряется ингибирование реакционных смесей (в частности, свободных радикалов), генерированных определенными реакциями. Методом восстановления Fe3+ до Fe2+ (метод FRAP) также можно суммарно определять антиоксиданты, однако не все, в частности тиолы, так как их восстановительный потенциал значительно ниже потенциала превращения Fe3+ в Fe2+ [20]. Амперометрический метод успешно был применен для определения антиоксидантной способности разных вин [21]. Это прямой, точный, объективный и быстрый метод. Он был применен для определения антиоксидантной способности оливковых масел из разных стран [22]. Метод позволяет оценить качество, подлинность оливкового масла. Амперометрический (электрохимический) метод применяется также для определения антиоксидантного статуса человека [23]. Общие принципы электрохимического определения рассмотрены в обзоре (24). Амперометрический детектор в комбинации с высокоэффективной жидкостной хроматографией широко используется для определения полифенолов в пищевых продуктах и напитках (25) и кверцетина после употребления зеленого чая, аскорбиновой и дигидроаскорбиновой кислот в плазме и спинно-мозговой жидкости [26].
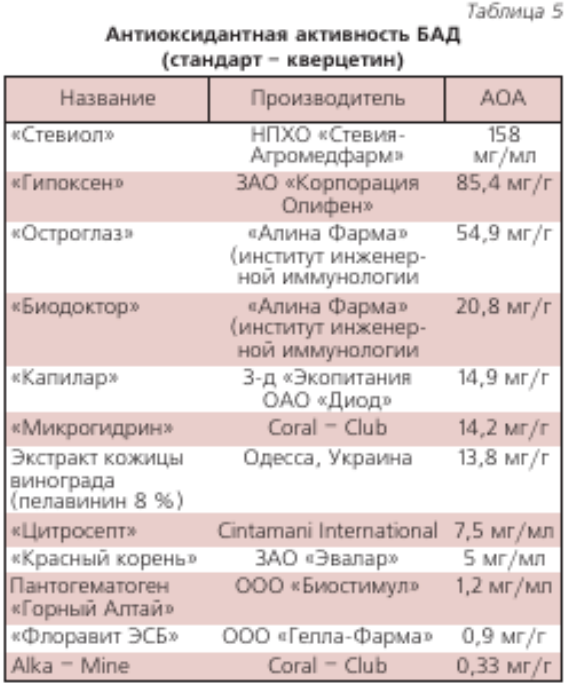
В НТЦ «Хроматография» НПО «Химавтоматика» выполнен большой объем измерений антиоксидантной активности (АОА) разных пищевых продуктов и напитков [29–31]. В табл. 1, 2, 3 приведена относительная АОА свежевыжатых соков фруктов и овощей урожая 2005 г., которая зависит от их сорта, места произрастания и времени хранения. АОА пчелиного меда разных сортов находится в пределах 0,05’ 0,45 мг/г (образцы меда были получены на ярмарках меда в Коломенском и в Манеже в 2003-2007 гг.). В табл. 4 приведена АОА основных напитков, в табл. 5 — некоторых БАДов.
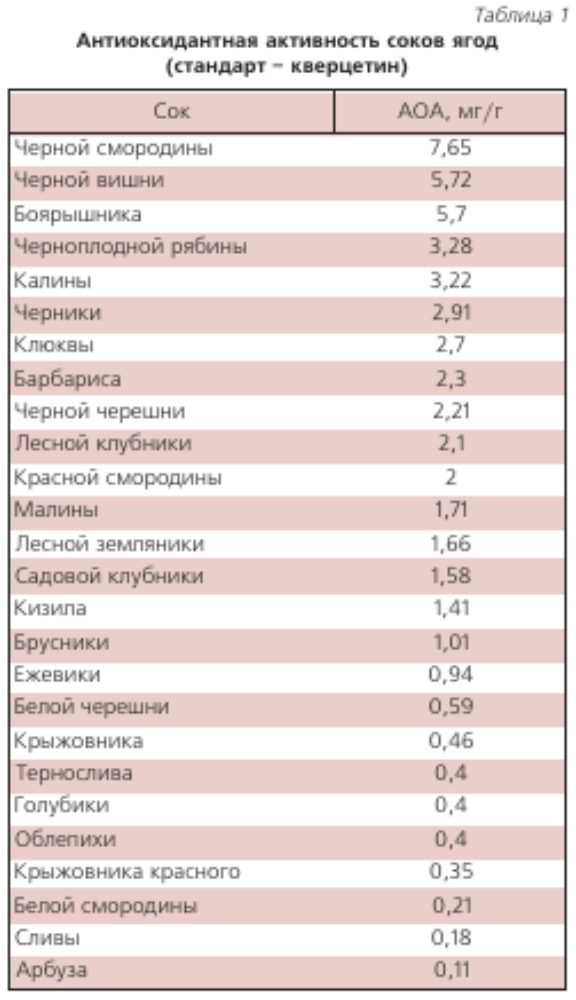
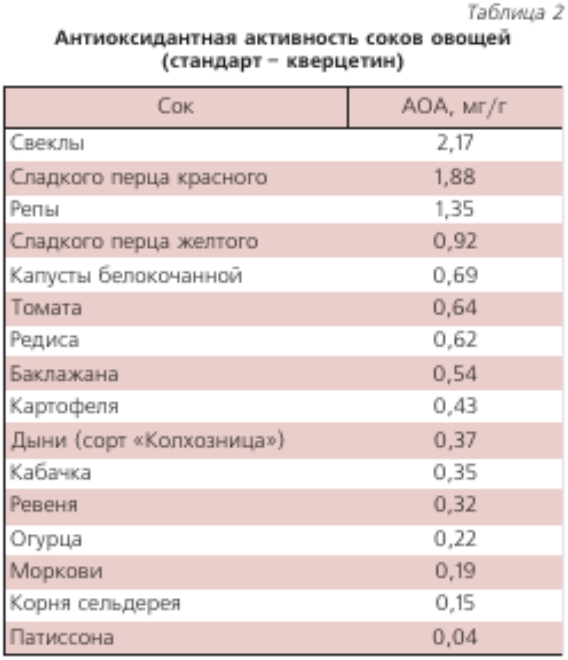

Для водорастворимых проб в качестве стандарта использовали кверцетин (фирмы «Флука»). Перед измерениями строили градуировочный график зависимости сигналов кверцетина (площади пиков) от концентрации кверцетина. Значение суммарного содержания антиоксидантов в соках, в частности, в черной смородине 9.7 мг/мл, означает, что АОА 1 мл сока черной смородины равна 9,7 мг кверцетина.
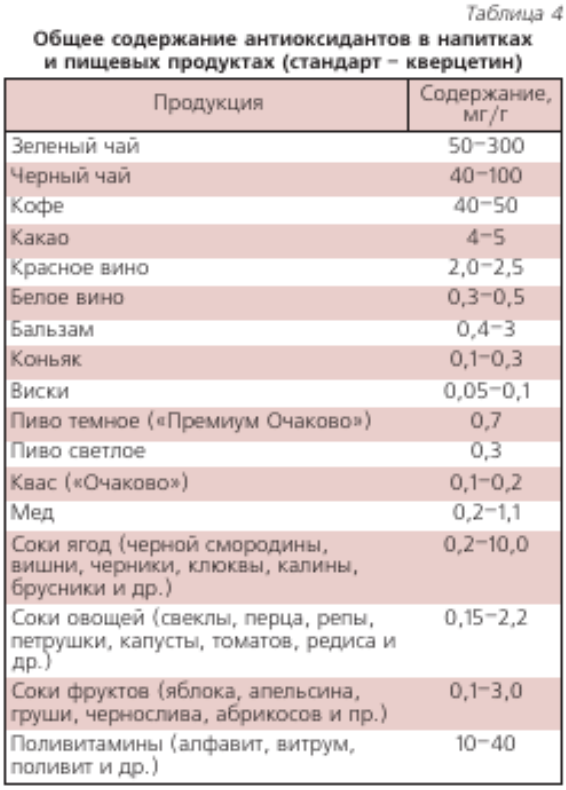
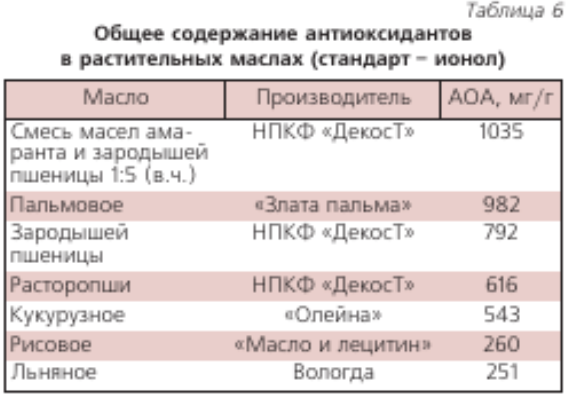
Для определения содержания антиоксидантов в жирорастворимых пробах, в частности, в растительных маслах в качестве стандарта применяли ионол (табл. 6). Очень высокое антиоксидантов содержание в масле амаранта и зародышей пшеницы, а также пальмовом масле. В последнем обнаружено много изомера витамина Е–Y-токотриенола, обладающего значительно большей АОА, чем наиболее распространенный изомер витамина Е–?-токоферол.
Знания суммарного содержания природных антиоксидантов в основных пищевых продуктах и напитках позволяют использовать их для антиоксидантной терапии, а также для создания напитков и пищевых продуктов с повышенной АОА.
ЛИТЕРАТУРА
Я.И. Яшин, А.Я. Яшин, П.И. Черноусова
Научно-технический центр «Хроматография» НПО «Химавтоматика»
Первое упоминание о чае было 5 тыс. лет назад в Китае, в провинции Юньнань.
В настоящее время чай — наиболее распространенный напиток в мире, его употребляют 2 / 3 населения земного шара, причем значительно чаще, чем кофе. Ежегодно в 40 странах мира производят более 3 млн. т чая. Основные производители чая (тыс. т): Индия — 850, Китай — более 700, Шри-Ланка — около 300, Кения — 270, Индонезия — 150, Япония — более 100, Южная Африка — около 100, Вьетнам — 75, Аргентина — 50.
Общее производство и продажу чая оценивают в 20 млрд долл. США. Цена некоторых элитных сортов чая достигает более 1000 долл. США за 100 г.
В мире имеется более 3000 коммерческих сортов чая. хотя чайного растения Camellia sinensis всего два вида.
В зависимости от степени ферментации чай классифицируется на зеленый, желтый, белый, красный и черный. Зеленый чай производится без предварительной ферментации, желтый, белый и красный — с частичной ферментацией и черный чай — с полной ферментацией. В основном потребляются черные и зеленые сорта чая, их производят примерно в соотношении 80 и 20 %.
Наилучшие условия для выращивания чая — влажный и жаркий климат, условия вечной весны. В таких условиях чайное растение быстро растет, постоянно дает новые побеги. На качество чая влияют многие природные факторы: влажность, температура, высота, время сбора, тип почвы, близость гор или моря. Естественно, качество чая зависит также от технологии переработки, хранения, упаковки и пр.
В последние годы интерес к чаю значительно возрос из-за высокого содержания в нем сильных антиоксидантов. В настоящее время признано, что причина многих болезней, а также процесса старения людей — действие свободных радикалов в биологических жидкостях, которые, как сильные окислители, повреждают стенки сосудов, мембраны клетки, окисляют липиды. Эти воздействия приводят к сердечно-сосудистым, онкологическим заболеваниям, диабету и многим другим опасным болезням.
Систематическое употребление чая подавляет вредное воздействие свободных радикалов в биологических жидкостях человека.
Сильная антиоксидантная активность чая в основном связана с катехинами, присутствую щ ими в больших количествах. особенно в зеленом чае.
В последние годы появились многочисленные научные публикации о предотвращении и подавлении онкологических заболеваний полифенолами чая [1–5], в частности катехинами зеленого чая [6–8], теафлавинами черного чая [9] общие обзоры на темы: чай и рак [10], чай и здоровье [11,12], предотвращение рака полифенолами чая и оптимизация здоровья [13], исцеление чаем [14] и многие другие.
В настоящее время химический состав разных сортов чая широко исследуется хроматографическими методами. Современные хроматографические методы наиболее пригодны как для рутинных, так и для исследовательских анализов. В последние годы вышли десятки обзоров и статей по анализу чая хроматографическими методами. Для определения компонентов чая используют основные аналитические методы хроматографии: газовой, жидкостной, ионной [15–21].
Для идентификации неизвестных соединений применяют комбинированные методы: газовую хроматографию — мас-спектрометрию, высокоэффективную жидкостную хроматографию — мас-спектрометрию, жидкостную хроматографию — ИКС, жидкостную хроматографию — ЯМР.
Для выделения катехинов в чистом виде из экстрактов зеленого чая используют препаративную жидкостную хроматографию, для выделения теафлавинов в чистом виде применяют противоточную хроматографию.
Для повышения чувствительности анализа применяют метод микротвердофазной экстракции, а также концентрирование на специальных адсорбционных картриджах.
Катехины и другие компоненты чая определяли не только в водных настоях, но и в биологических жидкостях организма человека после употребления чая, в частности, в моче, плазме, желудочном соке, слюне [16].
Для определения химического состава чая чаще всего применяют высокоэффективную жидкостную хроматографию (ВЭЖХ) с УФ-детектором [19]. Кроме того, используют электрохимические (амперометрические и кулонометрические) [16, 17], масс-спектрометрические, флуоресцентные и хемилюминесцентные детекторы.
Газовую хроматографию с пламенно-ионизационным детектором применяют для анализа органических летучих компонентов, определяющих аромат чая.
В последние годы для анализа состава чая используют также методы капиллярного электрофореза, в основном зонный капиллярный электрофорез и мицеллярную электрокинетическую капиллярную хроматографию. Реже применяют методы тонкослойной и бумажной хроматографии.
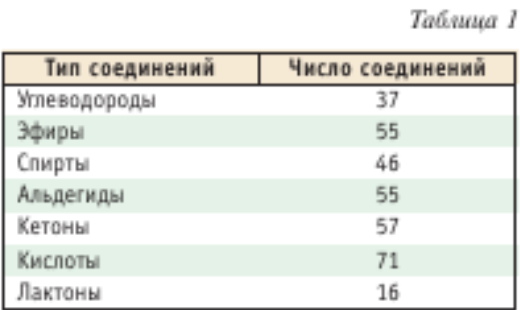
Для анализа компонентов чая используют и другие методы: спектрофотометрию, хемилюминесценцию, ЯМР, биосенсоры, ИКС. В Японии разработан и выпускается ИКС-анализатор чая. Несмотря на огромные возможности методов хроматографии и других методов, официальные методы контроля чая — органолептические или устаревшие аналитические методы. Весьма актуально скоррелировать заключения дегустаторов чая с результатами химического анализа чая современными хроматографическими методами. Химический анализ чая позволил бы связать качество чая и его полезные и лечебные свойства с содержанием определенных компонентов и тем самым оптимизировать технологию производства чая. Аромат чая определяется многими летучими соединениями. В табл. 1 приведен перечень классов и число соединений, идентифицированных методом ГХ-МС в аромате черного чая [20].
Всего идентифицировано около 500 летучих соединений. Среди летучих соединений обнаружены также разные производные фурана, пиррола и др. Считается, что спирты образуются в чайных листьях за счет биосинтеза. Однако большинство летучих соединений чая образуются в процессе технологической обработки из каротиноидов, липидов и аминокислот.
Для идентификации соединений, определяющих аромат чая, используют метод ГХ-МС в сочетании с методом концентрирования «head-space» (анализ равновесного пара).
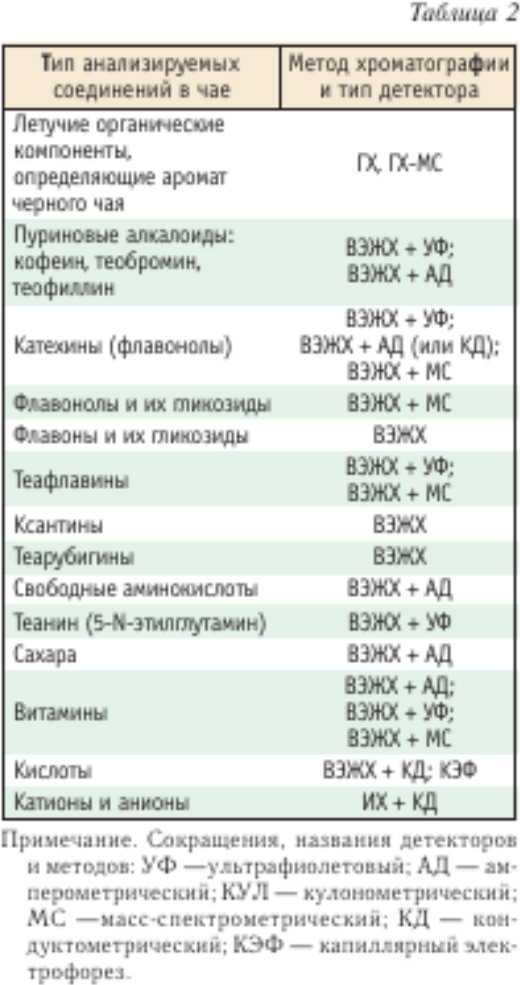
Перечень соединений, анализируемых в чае хроматографическими методами, приведен в табл. 2.
Ниже приведены сведения о содержании соединений, представленных в табл. 2, в разных сортах чая хроматографическими методами.
Катехины (флавонолы). В зеленом чае выявляют от 4 до 12 типов катехинов, которые составляют до 15–30 % от сухого листа. Структурные формулы восьми наиболее часто встречающихся катехинов изображены на рис. 1. Как указано выше, эти катехины — сильнейшие антиоксиданты. В черном чае содержится только 9 % катехинов, так как в процессе ферментации они окисляются в теафлавины и теарубигины. Содержание катехинов в зеленом чае, определенных хроматографическими методами, колеблется от 10 до 120 мг / г (на 1 г сухого чая) в зависимости от сорта и качества чая. Больше всего содержится четыре типа катехинов: эпигаллокатехин (ЭГК), эпигаллокатехин галлата (ЭГКГ), эпикатехин (ЭК) и эпикатехин галлата (ЭКГ). В меньших количествах встречаются галлокатехин, катехин и галлокатехин галлат.
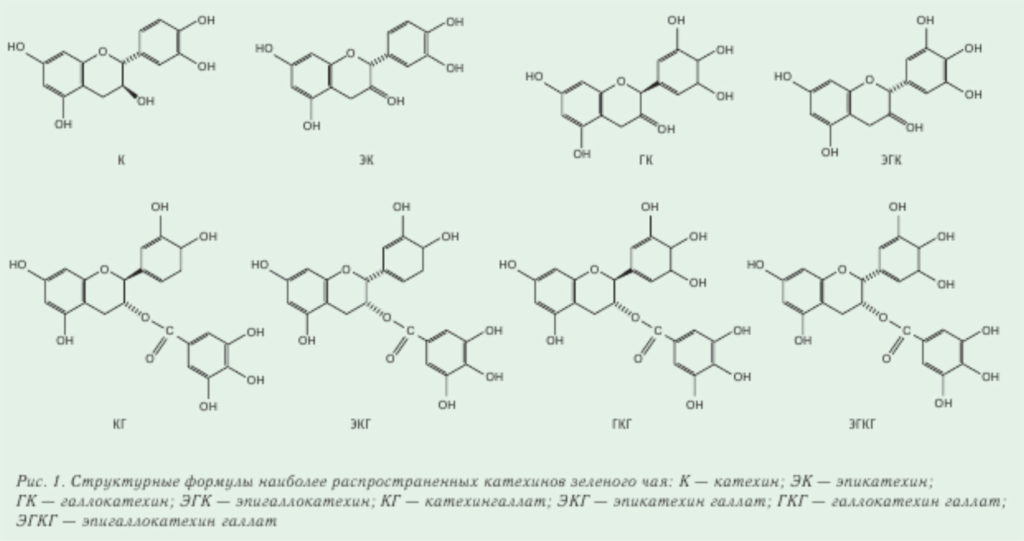
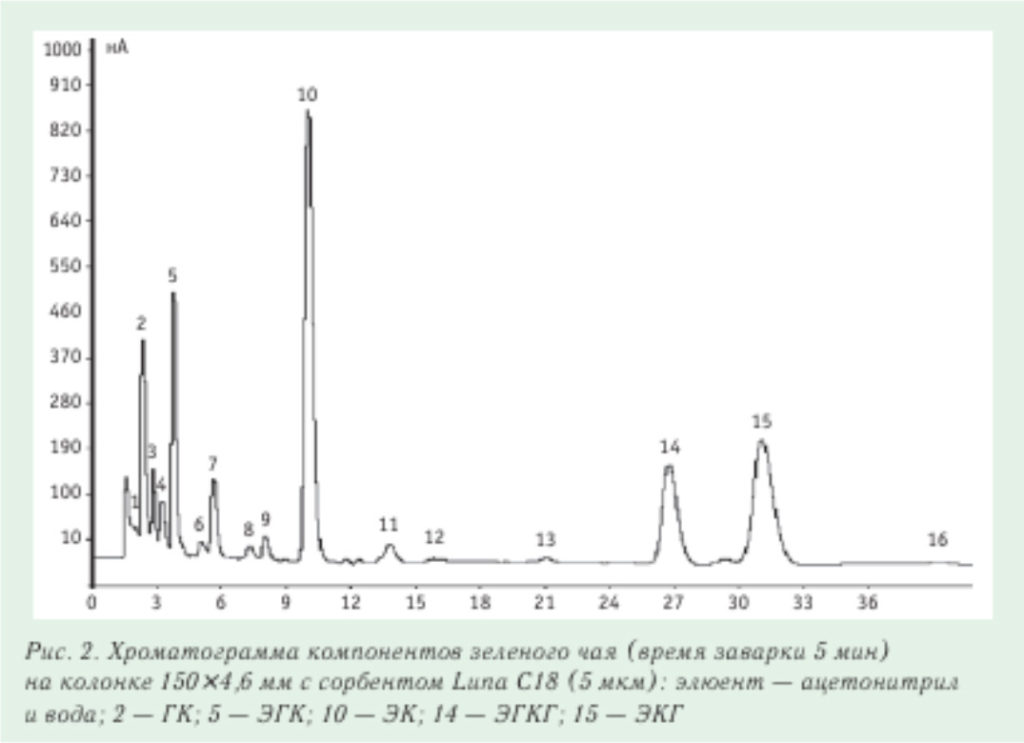
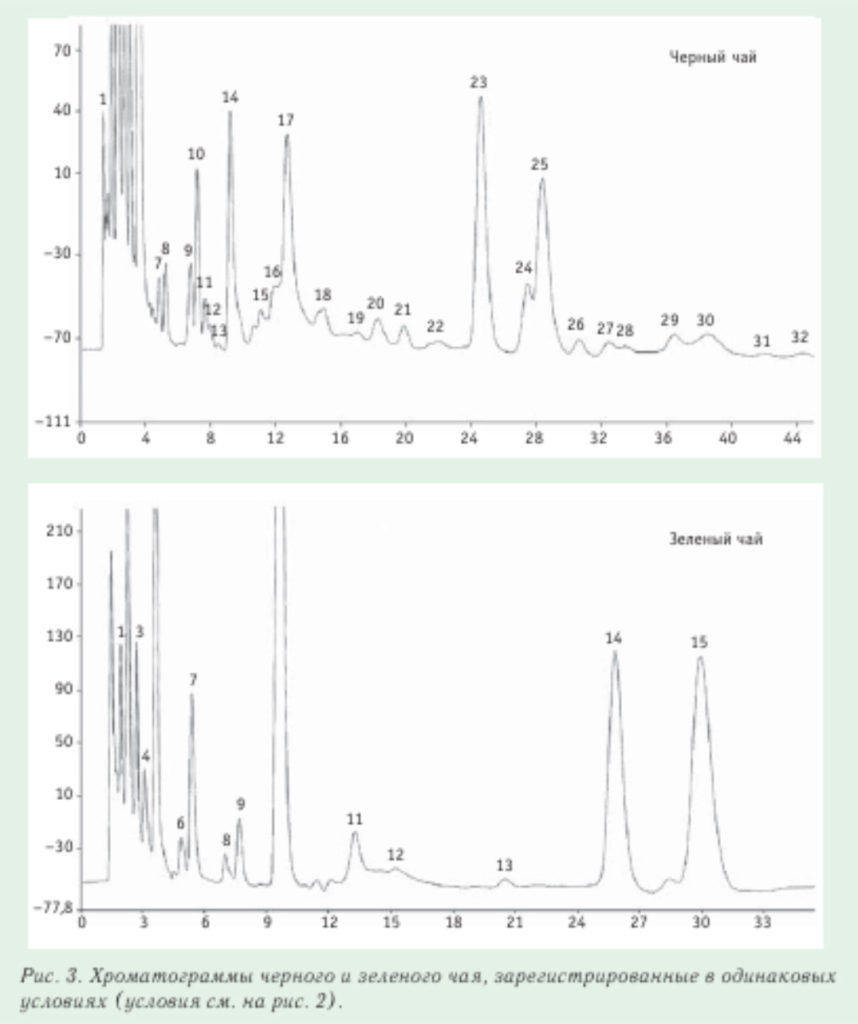
Хроматограмма катехинов зеленого чая, полученная на жидкостном хроматографе «ЦветЯуза» (НПО «Химавтоматика») с амперометрическим детектором в окислительном режиме, приведена на рис. 2. В этом случае регистрируются только соединения, способные окисляться. Предел детектирования катехинов на «ЦветЯузе» — на уровне нг/мл, линейный диапазон — от 5 до 1000 нг/мл. На рис. 3 приведено сопоставление хроматограмм черного и зеленого чая. зарегистрированных в одинаковых условиях. Из данного рисунка видно, что состав этих сортов чая сильно различается.
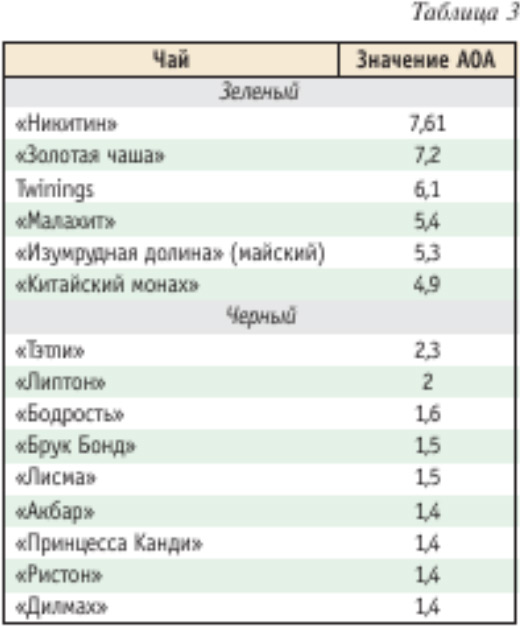
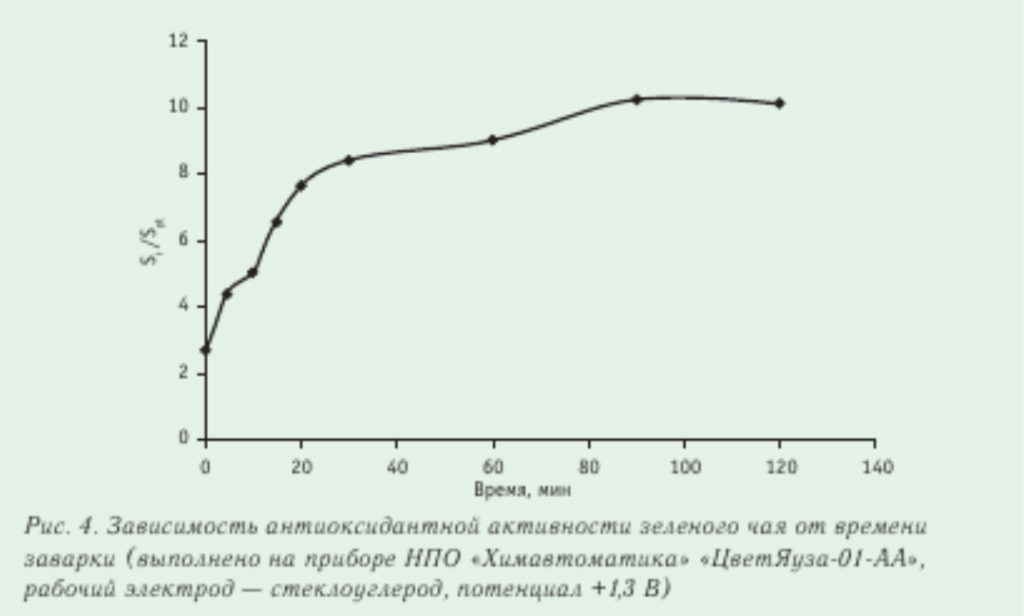
Было определено суммарное содержание катехинов в чае после заварки в течение 5–120 мин. Оказалось, что общее содержание катехинов возрастает во времени (рис. 4) до 20 мин. Из этих данных следует, что наибольшая антиоксидантная активность зеленого чая после 20 мин заварки. Измерения были выполнены с помощью прибора «ЦветЯуза-01-АА» (анализатора антиоксидантной активности) НПО «Химавтоматика». В табл. 3 приведена антиоксидантная активность (АОА) зеленых и черных сортов чая. Данные опубликованы в работе [22], измерения были выполнены также на приборе «ЦветЯуза-01-АА». Есть прямая связь антиоксидантной активности чая с качеством его исходного сырья. Антиоксидантная активность чая в основном связана с содержанием катехинов, особенно это справедливо для зеленого чая. В рекламной литературе на чай приводятся сведения, что в почке может содержаться до 30 % катехинов от сухой массы, в первом листочке — 25 %, во втором листочке — 20 % и т. д. Из табл. 3 видно, что антиоксидантная активность зеленого чая в среднем в 3 раза выше, чем черного.
В работе [23] определены катехины в трех сортах китайского зеленого чая, в двух сортах зеленого японского чая, в черном японском чае и в порошковом зеленом японском чае методом ВЭЖХ с амперометрическим детектором. Суммарное содержание катехинов в разных сортах китайского зеленого чая (Luan Guapian, Longjin, Maofeng) было соответственно 91.6, 100,4 и 123,3 мг /г (на 1 г сухого чая), в японских (suntory, dynasty) — 86,8; 95.4 мг/л, в черном чае (hoji-cha) — 11,5 мг, в зеленом японском порошковом чае (sunphenon) — 170,5 мг/г.
Следует обратить внимание, что катехинов в черном чае содержится в 8-15 раз меньше, чем в зеленом. Наибольшее число катехинов содержится в порошковом зеленом чае, используемом на чайных церемониях. Из общего содержания катехинов в зеленом чае 54–70 % составляет EGCG, 8–19 % — EGC, 9–12 % — ECG, 2–8 % — ЕС, все остальные — менее 5 %.
В работе [19] методом ВЭЖХ были определены четыре основных катехина, галловая кислота и кофеин в зеленых сортах чая (Meifo, Shanghai, Jasmine, Hangzhon Lung Ching), «Оолонг» (Fajian, Jiangxi), черный чай (Fujian) и Pu-erth.
Содержание катехинов в зеленых сортах чая (мг/г) EGCG: в пределах 51–63, EGC — 27–37, ECG — 11–22, ЕС — 7–10, соответственно. В чае «Оолонг» содержание этих катехинов в 2–2,5 раза меньше. В черном чае в 10 раз меньше. Содержание галловой кислоты во всех образцах чая колебалось в пределах 0,4–5 мг/г, содержание кофеина — в пределах 0,7–3 мг/г.
Капиллярным электрофорезом были определены основные катехины, кофеин, теофиллин и аскорбиновая кислота в зеленых сортах японского чая sencha и gyakuro [24] (мг/л): EGCG — 300–500, ECG — 60–120, EGC — 140–450, ЕС — 51–150. Содержание кофеина обнаружено в пределах 160–260 мг/л, теанина — 230–250 мг/л и аскорбиновой кислоты — 30–80 мг/л.
Катехины определяли в биологических жидкостях (плазме, слюне и моче) через 1 ч после употребления чая. Было обнаружено в плазме EGCG — 170–180 мкг/л, EGC — 150–160, ECG — 85–87, ЕС — 64–71 мкг/л [16].
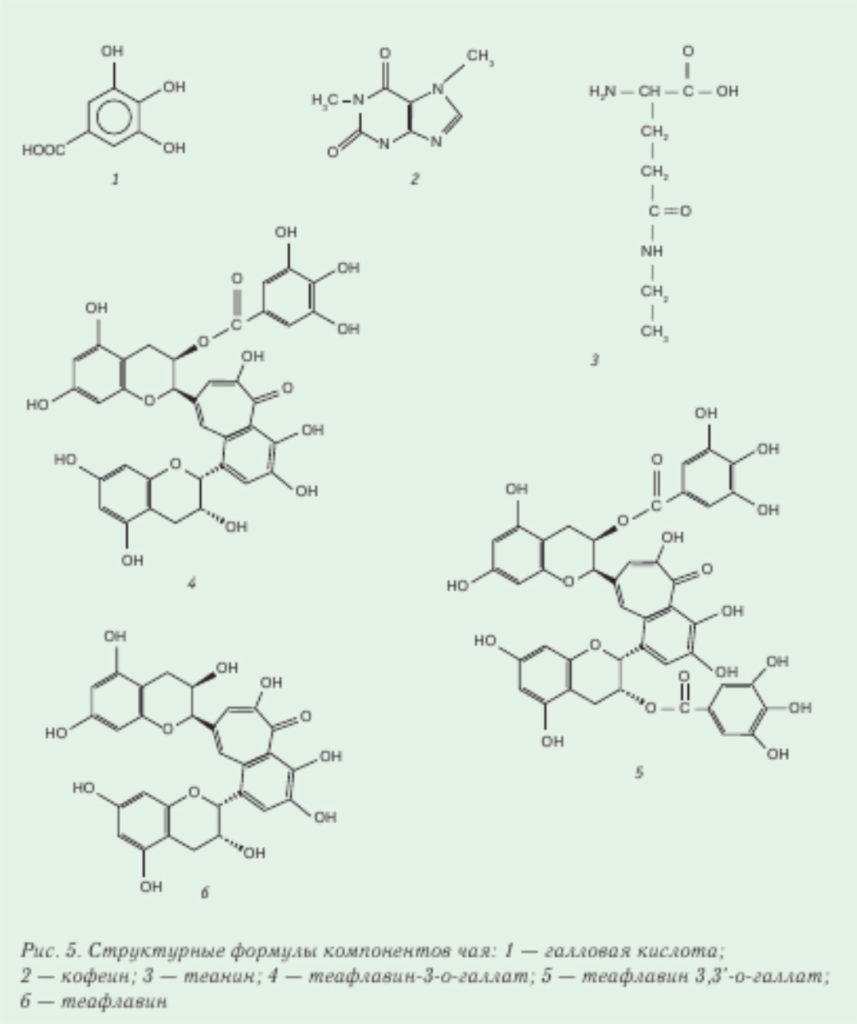
Теафлавины содержатся в черном чае в пределах 3–6 % (от сухой массы), от их содержания зависит интенсивность оранжево-красного цвета чая. В зеленом чае этих соединений мало. В процессе ферментации катехины под воздействием окислительной реакции, катализируемой энзимами, превращаются в теафлавины. Методом ВЭЖХ смесь разделяется: теафлавин, теафлавин-3-галлат, теафлавин-З.З’-галлат [20]. С труктурные формулы теафлавинов приведены на рис. 5.
Теарубигины — высокомолекулярные соединения с молекулярной массой в пределах 1 000–40 000 Da [20], в черном чае их может содержаться в пределах 12–18 % от сухой массы. Теарубигины придают более интенсивное окрашивание заварке чая, чем теафлавины. Разные фракции теарубигинов извлекали этилацетатом, диэтиловым эфиром, н-бутаном. При определенных условиях теарубигины разлагали на антоцианидины, галловую кислоту и флавонолы.
Методом гельхроматографии разделяли теарубигины и детектировали спектро-фотометрическим детектором при длинах волн 440–460 нм.
Пуриновые алкалоиды. Содержание кофеина в черном чае колеблется в пределах 1,5–4 %, теобромина— 0,2–0,4 % и теофиллина — менее 0,02 % [19]. В литературе продолжаются дискуссии о пользе и вреде кофеина. В США широко распространено употребление чая без кофеина.
Аминокислоты. В чае определяют следующие свободные аминокислоты: глутамин, аспарагин, аланин, треонин, серин, пролин, изолейцин, лейцин, метионин, глутаминовую кислоту, гистидин, фенилаланин, тирозин. Их содержание в зеленом чае в пределах 0,1–10 мг/г [18]. Содержание аминокислот в зеленом чае служит критерием его качества, в частности содержание теанина в японском зеленом чае служит показателем его высокого качества. Он придает деликатный вкус настоям чая. В последние годы теанин отнесен к антиканцерогенным соединениям, он также уменьшает содержание норадреналина и серотонина в мозгу, снижает давление. В некоторых сортах японского зеленого чая теанин содержится в пределах 8–10 мг/г, глутамин — в пределах 1,5–3 мг/г. Структурная формула теанина приведена на рис. 5.
Сахара. В зеленом чае в основном содержатся: глюкоза — в пределах 0,6 -1,3 мг/г, фруктоза — 0,4–0,9 мг/г и сукроза — 6–1 0 мг/г. Разработан простой, эффективный и прямой метод одновременного определения свободных аминокислот и сахаров с использованием анионообменной хроматографии и амперометрического детектора с золотым рабочим электродом [18]. Ранее эти анализы выполняли с пред- или послеколоночной дериватизацией сахаров.
Витамины. Опубликованы методики анализа витаминов чая методами хроматографии, в частности витамина С, витамина Е (токоферолов ?, ?, ?). В чае обнаружены также витамин К. почти все витамины группы В и редкий витамин Р, укрепляющий стенки кровеносных сосудов и предотвращающий внутренние кровоизлияния.
В чае методом ВЭЖХ с амперометрическим детектором определяют аскорбиновую кислоту. В зеленом чае ее обнаружено около 1,7–2 мг/г . Витамина Е найдено на порядок меньше. Количество витаминов С и Е сильно уменьшается после ферментации, поэтому в черном чае этих витаминов содержится значительно меньше; ?-?-каротиноиды и хлорофиллы определяются в зеленом чае также методом ВЭЖХ.
Катионы и анионы. Методом ионной хроматографии и капиллярного электрофореза в чае выявляют катионы щелочных и щелочноземельных металлов, аммоний, а также основные анионы, включая оксалаты, могут образовывать камни в почках. Для сердечной деятельности особенно важно высокое содержание калия в чае. Из-за возможной токсичности AI разработаны методики его определения с послеколоночной дериватизацией методом эксклюзионной хроматографии. Тяжелые металлы определяли в растворах чая методом ВЭЖХ с индуктивно связанной плазмой в качестве детектора [20].
Кислоты. Основная фенольная кислота в чае — галловая (рис. 5). В нем присутствуют и эфиры галловой кислоты, в частности теогаллин. Содержание галловой кислоты в китайских образцах чая определено в пределах 0,4–1,6 мг/г (от сухой массы).
Методом капиллярного электрофореза одновременно определяют щавелевую, яблочную, лимонную, хинную и аспарагиновую кислоты.
Анионообменная хроматография была применена для определения уксусной, аскорбиновой, сукциновой, яблочной, лимонной, щавелевой, фосфорной, соляной и серной кислот одновременно.
Из приведенного краткого обзора видно, что методы хроматографии широко применяют для исследования состава чая. К сожалению, пока имеются трудности при анализе теарубигинов, пептидов и белков.
Из вышеприведенных сведений бесспорно следует, что наиболее полезен зеленый чай, так как он содержит катехины в неокисленной форме, а они обладают наибольшей антиоксидантной активностью. Кроме того, зеленый чай содержит на порядок больше витаминов С и Е. В статье [22] приведены исследования по антимутагенной активности чая. Многие экспериментальные данные убедительно подтверждают сильный антимутагенный эффект от воздействия зеленого чая.
Проведены клинические испытания воздействия употребления зеленого чая на рост опухолей. Отмечена задержка роста опухолей. Планируются новые обширные клинические испытания.
Считается, что употребление 5-10 чашек зеленого чая в сутки защищает от появления опасных заболеваний.
В черном чае много летучих химических соединений, большинство из которых в лучшем случае неполезны, некоторые вредны. В связи с этим предлагается два разных способа заварки черного чая.
Первый способ — традиционный, рекомендуемый всеми фирмами-производителями. Предлагается употреблять чай после 5 мин заварки кипящей водой. Этот чай возбуждающий, он содержит много кофеина, но также содержит много синтетических химических соединений, образовавшихся при окислении ферментами.
Второй способ — чай заваривается, перемешивается и через 1–1,5 мин этот настой сливается, затем снова заливается и настаивается 5 мин и более. Такой чай содержит меньше низкомолекулярных летучих химических соединений (польза от которых, как уже указано, сомнительна) и меньше кофеина. Этот чай успокаивающий и более полезен, чем чай, заваренный по первому способу. При заварке по второму способу мало теряется полезных катехинов.
ЛИТЕРАТУРА